تدریس خصوصی و تشریح روند آموزش تضمینی

در هر سطح از این درس که باشید من شما را با زیبایی با بطن این درس آشنا خواهم کرد بطوریکه هیچوقت از ذهنتان فراموش نشده و بتوانید همراه با سعی و تلاش خود جزء کسانی باشید که همراه با من این درس را 100% زده اند.
برگزاری کلاسهای تشریح درس، نکته، تست، رفع اشکال، تکنیکهای تست زنی همراه با نمایش انیمیشنها و فیلمهای مربوط به این درس زیبا و مهم در گروه تجربی.
روند جلسات دو ساعته :
- 15 دقیقه کوئیز و حل و رفع اشکال تست های مربوط به جلسه قبل
- 90 دقیقه تشریح درس همراه با نکات کنکوری آن فصل
- 15 دقیقه تست های نمونه کنکوری از همان فصل
روند تدرس تضمینی کنکور:
- در هر جلسه 1 فصل از مجموع 30 فصل کتابهای زیست شناسی تدریس خواهد شد(بجز مبحث ژنتیک).
- هر 4 جلسه یک کوئیز کلی از مجموع فصلهای شرح داده شده بدلیل تعیین سطح پیشرفت و رفع اشکالات ممکن اجرا خواهد شد که به نوبه خود به روند دوره و تکرار دروس کمک خواهد کرد به عنوان مثال اگر 4 فصل اول از کتاب سال سوم شرح داده شود و زمان تست باشد کل سال دوم باضافه 4 فصل اول سال سوم تست گرفته خواهد شد.
- کلاسها بصورت خصوصی و یا نیمه خصوصی برگزارمی شود .
- بهتری نشیوه تدریس برای این برگزاری دوره کلاسها در دو تا سه روز در هفته است تا سستی یا بقول عموم پشت گوش انداختن در پروسه یادگیری اتفاق نیافتد.
تلفنهای تماس:
09121347016
محمد همدانی
معرفی سایت های مفید
آموزش ژنتیک
مجله ی وراثت
:http://jhered.oxfordjournals.org/
مجله ی ژنتیک ملکولی انسان از سری مجلات دانشگاه آکسفورد
:http://hmg.oxfordjournals.org/
وبسایت ژن و تکامل ارائه کننده ی بایگانی کاملی از مقالات در این زمینه از سال 1987
بخش ژنتیک مجله ی نیچر
:http://nature.com/ng/index.html
مجله ی آمریکایی ژنتیک انسانی زیر نظر دانشگاه شیکاگو، ارائه کننده ی آخرین اخبار
http://journals.uchicago.edu/AJHG/home.html
نسخه ی رسمی و حرفه ای مجله(ژورنال) اروپایی ژنتیک انسانی که در واقع بخشی
http://nature.com/ejhg/index.html
مرکز آموزش دانش ژنتیک و اخبار و تازه های این رشته به زبان انگلیسی:
انیمیشنهای زیبای زیست شناسی
ژن جدید اکسیر جوانی ابدی کشف شد
دانشمندان انگلیسی اعلام کردند که با آزمایش بر روی کرمها موفق به کشف ژنی شده اند که پیوند محکمی با طول عمر دارد و می تواند به عنوان یکی از ژنهای اکسیر جوانی ابدی معرفی شود.
بدانشمندان دانشگاه بیرمنگام که بر روی ژنتیک پیری مطالعه می کنند دریافتند که ژنی به نام DAF-16 که علاوه بر کرمها در بسیاری از حیوانات و انسان نیز وجود دارد می تواند سناریوی جدیدی در روش مبارزه با پیری و مسائل ایمنی و دفاع انسان بگشاید.
جمعیتهای جهانی از یک سو به دلیل بهبود خدمات بهداشتی و از سوی دیگر به دلیل کاهش تولد با یک ریتم بسیار سریع به سوی پیر شدن پیش می روند. نتایج تحقیقاتی که سال گذشته محققان دانمارکی انجام دادند نشان می دهد که نیمی از کودکانی که در عصر حاضر متولد می شوند می توانند تا 100 سالگی عمر کنند.
این محققان در این خصوص اظهار داشتند: "ما می خواستیم کشف کنیم که پیری طبیعی چقدر به ژنها وابسته است و اثرات این ژنها تا چه حد بر روی سایر ویژگیها مثل ایمنی اثر می گذارند. ما کشف کردیم که مسائلی از قبیل مقاومت و پیری گامهایی را به موازات هم بر می دارند."
دانشمندان انگلیسی با مقایسه طول عمر، مقاومت در برابر استرس و سیستم ایمنی در چهار گونه مختلف کرمها نشان دادند که در بین این گونه ها تفاوتهای قابل توجهی در رفتار ژن DAF-16 وجود دارد که این تفاوتها منجر به ایجاد تفاوتهایی در طول عمر، مقاومت در برابر سختیها و سیستم ایمنی این گونه ها می شود به طوری که در سطح حداکثر فعالیت DAF-16، مدت زمان زندگی و به موازات آن مقاومت و دفاع ایمنی در مقابل برخی ازعفونتها افزایش می یابد.
DAF-16 در بسیاری از سلولهای بدن فعال است و شباهت بسیاری به خانواده ای از ژنهای انسان به نام FOXO دارد.
براساس گزارش رویترز، این پژوهشگران اظهار داشتند: "تفاوتهای ناچیزی در شدت فعالیت DAF-16 در گونه های مختلف وجود دارد که به نظر می رسد این تفاوتهای جزئی نقش مهمی در پیری و سلامت ایفا کنند که بسیار جالب است و می تواند توضیح دهد که با دستکاری این ژن می توان بر روی طول عمر تحولات جدی ایجاد کرد."
انتقال ويروس ايدز از طريق اسپرم

آنا سبالوس محقق برجسته و معروف دانشگاه بوئينوس آيرس در آرژانتين پس از انجام آزمايشات جديد خود ادعا كرده است كه اسپرم هم ميتواند ويروس اچ.آي.وي را به ماكروفاژها، سلولهايT شكل و سلولهاي دندريت منتقل كند.
دكتر سبالوس و دستياران وي نشان دادند كه ويروس اچ.آي.وي به سطح اسپرم ميچسبد و اين اسپرمهاي حامل ويروس، آن را بهدندريتها و ساير سلولها و بافتهاي مورد هدف ويروس ايدز منتقل ميكند.
اسپرم بيانكننده و حامل مولكولهايي است كه در تعامل براي جاسازي ويروس ايدز نقش دارند، از جمله سولفات هپارين و گيرندههاي مانوس كه در انتشار ويروس ايدز در بدن نقش ايفا ميكنند. اين محققان نشان دادند كه ويروس اچ.آي.وي از راه سولفات هپارين به اسپرم متصل ميشود، اما گيرندههاي مانوس در عملكرد اسپرمي تاثيري ندارند. آزمايشات نشان داد: وقتي ويروس ايدز به اسپرم متصل شد در محيط كشت بافت از طريق اسپرم به سلولهاي دندريت ميرسد، سپس سلولهاي دندريت در تعامل با ويروس در بدن سبب بروز التهاب ميشود.
محققان معتقدند كه پروسه تضعيف سيستم ايمني بدن توام با بروز اين التهاب، انتشار ويروس ايدز را در بدن تشديد ميكند.
كشف روشي براي خشك كردن موقت سلولها با قابليت احياي مجدد
دانشمندان چك با همكاري دستياران ايتاليايي خود موفق به كشف روش جديدي براي ذخيره و نگهداري سلولها شدند تا بتوان در مواقع ضرورت آنها را احيا كرد.
به گزارش سرويس «علمي» خبرگزاري دانشجويان ايران (ايسنا)، پژوهشگران پراگ و ساردينيا اولين محققان در جهان هستند كه روش خشك كردن موقتي سلولها را براي زنده كردن دوباره آنها در صورت لزوم كشف كردهاند.
براساس گزارش كريستن ساينس مانيتور، پژوهشگران از اين روش در شبيه سازي جنينهاي گوسفند استفاده كردند.
با اين كشف به زودي پژوهشگران ميتوانند يك بانك اطلاعاتي از سلولهاي خشك شده متعلق به گونه هاي جانوري رو به انقراض تاسيس كنند. به اين ترتيب ميتوان از اين ذخيره براي شبيه سازي اين جانوران در آينده استفاده كرد.
اين مطالعات در موسسه تحقيقات توليدات حيواني فرهنگستان علوم چك انجام شده است.
براساس اين گزارش، تاكنون اسپرم تنها سلول داراي هسته بوده كه دانشمندان ذخيره آن را در وضعيت دهتيراته (بدون آب) كنترل كردهاند.
پژوهشگران در آينده ميتوانند از اين روش براي كمك به احياي اعضاي بدن كه مورد حمله سرطانها قرار گرفتهاند به استفاده نمايند.
قند ضد یخ درون سلولی
استفاده از موجهاى تراهرتز براى رديابى واكنشهاى درون سلولى
ایتفاده ازطول موجهاى مختلف در ساخت لوازم خانگى و زندگى روزمره عادى شده است. غذا را مىتوان به سرعت در ميكرووله گرم كرد و يا تلويزيون را از راه دور كنترل كرد. اما دقيقأ بين اين دو نوع مختلف طول موج، فركانسى قرار دارد كه تا كنون از آن استفاده تكنيكى نشده است: موجهاى تراهرتز Terahertz-Wellen. هر روز دامنه تحقيقات در زمينه نحوه استفاده از امواج تراهرتز گستردهتر مىشود.بزودى شاهد لامپها و دوربينهايى خواهيم بود كه به كمك امواج تراهترز عمل خواهند كرد.
فيزيكدانان دانشگاه بوخوم در آلمان سعى مىكنند با كمك اين امواج چگونهگى و نحوه عملكرد فعاليتهاى زيستى را رديابى كنند. يكى از موضوعاتى كه از مدتى پيش در دست تحقيق است، بررسى خواص قند در فعاليتهاى حياتى است. قند نه تنها انرژىزاست بلكه نقش مهمى نيز در حفظ تعادل فعاليتهاى زيستى بر عهده دارد. مثلأ سفيده تخممرغى كه با كمى قند مخلوط شده است، ديرتر خشك مىشود و حتى ديرتر هم يخ مىبندد. به عبارت سادهتر قند مانند ضديخ بيولوژيكى عمل مىكند.
مكانيسمى كه از مدتها پيش شناخته شده است. اما چگونه؟ اين پروسه جالب كاملأ ناشناخته است.
مارتينا هاونيت (Martina Havenith) يكى از فيزيكدان دانشگاه شهر بوخوم مىگويد:
”نظرات متفاوتى در اين زمينه وجود دارد، مثلاً مىتوان گفت ملكولهاى قند مىتوانند بين ملكولهاى آب سر بخورند و جايگزين شوند و يا شايد حضور قند روى خواص آب تأثير مىگذارد و حركت ملكولهاى آنرا كند مىكند.“
براى بررسى بيشتر و اثبات اين تئوريها ابتدا بايد بتوان حركات ملكولهاى تشكيل دهنده آب را بررسى كرد. اما اين ملكولها در مدت زمانى كمتر از يك بيليونيوم ثانيه جابهجا مىشود! سرعتى برق آسا كه به سادگى قابل رديابى نيست. روشهاى كه امروزه براى رديابى حركات ملكولى استفاده مىشوند بسيار كندتر از آن هستند كه بتوانند تصويرى از نوع حركت ملكولهاى آب نشان دهند. هاونيت معتقد است مىتوان از امواج تراهرتز در تصوير بردارى از اين حركات برق آسا استفاده كرد.
ليز يا سنسورهاى امواج تراهرتز آنقدر سريع هستند كه مىتوانند اين نوع حركات ملكولى را دنبال كنند. فيزيدانان بوخومى تلاش مىكنند از اين تكنولوژى براى رديابى و نحوه عمل ملكولهاى قند استفاده كنند. بررسىهاى صورت گرفته نشان مىدهند هر ملكول قند حدود صد وده ملكول آب اطرافش را تحت تأثير قرار ميدهد. ايجاد پيوند هيدروژنى ملكولهاى آب با قند، نوعى جاذبه ايجاد مىكند. به علت اين كشش ذرههاى آب اطراف قند نمىتوانند آزادانه به هر سو حركت كنند. اما چرا اين پيوند محكم ميان قند و آب از خشك شدن و يا يخ زدن سفيده تخممرغ جلوگيرى مىكند؟ فيزيكدان آلمانى هم نمىدانند.
هاوينت مىگويد: ”همه چيز هنوز در حد تئورى است. حتى مىتواند اينگونه باشد كه چون حركت ملكولى آب كندتر مىشود، تغييرات پروتئينى هم كندتر مىشود.“
اما در هر حال اين نظريه ثابت مىكند كه حضور آب در سلولهاى زنده حالت خنثى ندارد بلكه آب بصورت فعال در تمامى روندهاى سلولى شركت مىكند و نقش تعيين كنندهاى بر عهده دارد. هاوينت:
” تعريف تصويرى اين پروسه مانند اين است ملكولهاى آب را مثل بازيكنان فوتبال در نظر بگيريم كه از بيرون به درون ضربه مىزنند و يك پروسه مشخص را راه مىاندازند حال اگر اين ضربه آرامتر باشد پروسه هم آرامتر راه مىافتد.“
دقيقأ مانند خرسى كه در زمستان به خواب زمستانى فرو مىرود چون سوخت و ساز درون سلولىاش كندتر شده است. سفيده تخممرغ هم به علت كند شدن حركت ملكولهاى آب ديرتر يخ مىزند، ديرتر هم خشك مىشود. دست تئورى فيزيكى اينگونه به نظر مىرسد.
اما شايد روزى بتوان پس از شناخت مكانيسم اين روند، ضديخ قندى توليد كرد و يا از اين روش براى ساخت داروهاى جديد از آن استفاده كرد.
شبنم نوريان/رادیو صدای المان
چرا تعداد خانم ها بيش از آقايان است؟
حتما شنيده ايد كه كروموزوم Y در حال زوال است ، ولي آيا مردان رو به نابودي اند؟ زنان بخاطر داشتن تفاوتي سيتوژنتيكي از مردان متمايزند. يك كروموزوم X اضافي بجاي Y باعث شده است آنها زن باشند.

تقريباً يك دهه از زمان اولين پيشگويي دانشمندان در رابطه با از دست رفتن كروموزوم Y در مردان مي گذرد. در واقع كروموزوم Y باعث مي شود كه مردان ، مرد باشند. اما نقشه برداري اخير از ژنوم شامپانزه نشان داده است كه از كروموزوم Y محافظت مي شود. اين امر بخاطر تك همسري انسان است.
ژن هاي انسان در 23 جفت كروموزوم گسترش يافته اند كه 22 تاي آنها كاملاً مشابه مي باشند. كروموزوم 23 همانند يك سكه ي دو رويه در عالم بيولوژي محسوب مي گردد.
دو X بمعني زن بودن و X در كنار Y بمعني مرد بودن است. جفت هاي كروموزومي غالباً قطعاتي از DNA را طي فرايند نوتركيبي ، مبادله مي كنند. نقش نوتركيبي فعال نگه داشتن ژن ها مي باشد.
تا اواخر دهه 1990 عقيده بر اين بود كه كروموزوم Y انسان بخش عمده اي از ژن هاي كروموزوم X را ندارد تا بتواند با آن تبادل قطعه انجام دهد. نتيجه اين امر باعث كاهش و غير فعال شدن تدريجي ژن هاي كروموزوم Y مي گردد تا اينكه نهايتاً محو شود. بطوريكه پيشبيني شد نسل مرد بين 5 تا 10 مليون سال اينده از كره خاكي محو خواهد شد.
چون انسان و شامپانزه از يك جد مشترك در 6 مليون سال پيش منشا گرفته اند ، ديويد پيج (David Page) از مؤسسه Whitehhead در ماساچوست بر آن شد تا روند نمو كروموزوم Y در شامپانزه و همتاي انساني آن را مطالعه نمايد. آنچه او كشف كرد دور از تصور بود:
كروموزوم Y در شامپانزه بيشتر از Y ي انساني تحليل رفته بود.
پيج و همكارانش نتيجه گرفتند كه شامپانزه هاي ماده بعلت بي بند و باري و داشتن چندين شريك جنسي ، توانسته اند ژن هاي Y را به گونه اي القا كنند كه اسپرم هاي فعالي را توليد نمايند. در واقع بقول اين محققين جنگي بين اسپرم هاي شامپانزه وجود دارد. هر شامپانزه نر سعي مي كند ژن هاي خود را تحميل نمايد. در واقع طي اين روند ، ژن هاي غير توليد مثلي واقع بر كروموزوم Y ، سست و غير فعال شده اند. بعلاوه تحليل Y در شامپانزه شباهت هايي را با انسان نشان داده است. دانشمندان اين مؤسسه بر اين باورند كه اگر چه كروموزوم Y انساني در ابتدا ژن هايي را از دست داده اند ، ولي در قرون اخير نسبتاً پايدار شده است.
كروموزوم Y انسان از سرنوشت Y شامپانزه دور مانده است و اين امر بدليل تك همسري بودن و يا منوگامي بودن انسان است.
اسپرم انسان رقابت اسپرم هاي شامپانزه را نداشته است. بنابراين فشاري را براي توليد اسپرم قوي تر متحمل نشده است. تمام ژنتيك دانان معتقدند كه زوال كروموزوم Y در انسان متوقف شده است. جني آ. مارشال از دانشگاه ملي استراليا ، كانبرا ، مي گويد كه از 300 مليون سال گذشته كه كروموزوم Y انسان متولد شد ، بتدريج تحليل رفته است. ولي همچنان بحث ادامه دارد كه آيا كاهش ميزان مردان در مقايسه با زنان متوقف شده است و يا خير ؟
|
منبع: Popular Science |
فاکتور X عامل افزایش طول عمر زنان
در مقایسه بین دو جنس زن و مرد ، طبیعت به زنان کمک بیشتری کرده است. 
طبق گفته متخصصان علم ژنتیک زنان دو کپی از کروموزوم قوی X را دارند در حالیکه مردان تنها با یک کروموزوم X و کروموزوم نسبتا ضعیف Y متولد می شوند.
به گزارش هلث دی تحقیقات ژنتیکی نشان میدهد علاوه بر مشخص کردن مرز DNA بین پسران و دختران ، این تقسیم به زنان توانایی بیشتری را در دفع بیماری می دهد. حتی در دروان جنینی نیز تعداد جنین های پسری که با ناهنجاری های ژنتیکی می میرند بیشتر از جنین های دختر است. آنها زودتر می میرند ، و مطمئنا آسیب پذیر ترند.
به گفته دکتر باربارا می گون استاد ژنتیک در دانشگاه جان هاپکینز آنچه در باره علل تفاوت های دو جنس می شنویم به تفاوت های مرد و زن در تجارب زندگی یا هورمون ها و مسائلی از این قبیل محدود می شود. و آنچه باقی مانده تفاوت ژنتیکی اساسی بین دو جنس است. این تفاوت از این واقعیت ناشی می شود که زنان با دو کپی از کروموزوم توانمند X متولد می شوند.
مردم فکر میکنند کروموزوم X فقط به جنسیت مربوط می شود اما این کروموزوم 1000 ژن دارد که در کارهای مختلف از جمله دخالت در انعقاد خون ، دخالت در عملکرد عضله و نیز در رها شدن از محصولات زائد سلولی دخالت دارند.
ژن های کروموزوم X می توانند جهش یابند یا دچار ناهنجاری شوند و این هم می تواند منجر به بیماری شود. بنابراین اگر یک جهش در ژنی روی کروموزوم X رخ دهد فردمذکر کپی سالم آن را ندارد و فقط گرفتار همین ژن معیوب خواهد بود. اما فرد مونث با داشتن دو کروموزوم X ممکن است یک کپی نرمال ژن را روی کروموزوم X دیگر داشته باشد.
این پدیده نشان می دهد که زنان در برابر بیمای های خاصی مقاوم اند. اما یک مشکلی وجود دارد که متخصصان ژنتیک آن را mosaicism می نامند. ویژگی فوق اشاره به این واقعیت دارد که بیان همزمان هر دو کپی از ژن های موجود روی کروموزوم X برای سلولها کشنده است. بنابراین در سلول های هر زن یکی از کروموزوم های X خاموش است در حالیکه دیگری فعال است.
اما بطور کلی این ویژگی یک مزیت محسوب می شود چرا که به سلولهای بدن زنان این امکلن را داده است در برابر جهش های خطرناک انعطاف پذیر تر باشند. اما در برخی موارد نادر این مزیت روند معکوس پیدا می کند. برای مثال پزشکان مدتهاست دریافته اند زنان بیشتر مستعد بیماری های اتوایمیون مانند ام.اس هستند.
به گفته دکتر می گون در اوائل دوران تکامل جنینی در صد کوچکی از زنان ممکن است متحمل عدم تعادل در بیان ژنتیکی کروموزوم X شوند که در آن یک طرف برنده می شود. این امر فرآیندهای مهمی مانند فرایند شناخت خودی (که در آن سیستم ایمنی یاد می گیرد سلولها و بافت های خودی را از غیر خودی تشخیص دهد) را تحت تاثیر قرار می دهد. اگر این فرآیند تشخیص بافت خودی از مسیر خود منحرف شود بیماری اتوایمیون رخ می دهد.
جام جم آنلاین
شواهد تازه از انتقال DNA بين حشرات خونخوار و پستانداران

دانشمندان در يك تحقيق جديد به شواهدي از انتقال مواد ژنتيكي بين حشرات خونخوار و پستانداران دست يافتهاند.
براساس اين گزارش محققان دانشگاه تگزاس در آرلينگتون امريكا به اولين مدارك و شواهد قطعي از انتقال افقي dna كه جابهجايي مواد ژنتيكي بين گونههاي بدون جفتگيري، بين بيمهرگان انگلي و برخي از ميزبانان مهرهدار آنها اطلاق ميشود، دست پيدا كردهاند.
محققان در اين پژوهش روي انتقال ترانسپوزون از نوعي حشره خونخوار بومي امريكاي جنوبي و يك حلزون آبگيري به ميزبانان آنها مطالعه كردند.
ترانسپوزون بخشي از مولكول وراثتي dna است كه ميتواند خود را تكثير كند و داخل ژنوم به موقعيتهاي مختلف تغيير مكان دهد.
اين فاكتور ميتواند سبب جهشهاي ژنتيكي، تغيير در ميزان dna در سلول و تأثير فاحش روي ساختار و عملكرد ژنوم در منطقه استقرار ترانسپوزون شود. اين تحقيقات نشان داد ترانسپوزونهايي كه در اين حشرات يافت ميشوند در 98 درصد ميزبانهاي پستاندار اين انگلها شناخته شده هستند.
زیست شناسی ویروس ایدز (HIV)
اچ آی وی ويروسی است که به بيماری مرگبار ايدز منجر می شود. اين ويروس با حملات بی امان خود سيستم دفاعی بدن را چنان تضعيف می کند که حتی کوچکترين عفونت ها جان بيمار را به خطر می اندازند.

تاکنون دست کم 28 ميليون نفر در سراسر جهان در اثر ابتلا به ايدز در گذشته اند.
در حالی که 20 سالی است از شناسايی اچ آی وی می گذرد، هنوز هيچ واکسنی برای اچ آی وی و معالجه ای برای ايدز کشف نشده است. با اين حال نسل تازه داروها، طول عمر افراد آلوده به اچ آی وی را به طور چشمگيری افزايش می دهد.
ويروس اچ آی وی
اچ آی وی (Human Immunodeficiency Virus) به سيستم دفاعی، يعنی دقيقا همان سيستمی که معمولا در مقابل عفونت ها از بدن دفاع می کند، هجوم می برد.
اين ويروس به يک نوع خاص از گلبولهای سفيد خون به نام "سی دی 4 +" حمله می کند. اچ آی وی اين سلول را ربوده، ژن های خود را وارد دی ان ای آن می کند، و از آن برای توليد ذرات ويروسی بيشتری استفاده می کند. اين ذرات سپس ساير سلول های سالم سی دی 4 + را آلوده می کنند.
آن دسته از سلول های سی دی 4 + که ميزبان ويروس اچ آی وی هستند در نهايت از بين می روند. نحوه نابودی اين سلول ها هنوز برای دانشمندان مجهول است.
با کاهش شمار سلول های سی دی 4 + توانايی بدن برای مبارزه با بيماری ها افت می کند و به تدريج به سطحی خطرناک می رسد. از اين مرحله به بعد بيمار به ايدز (Acquired Immune Deficiency Syndrome) مبتلا شده است.
اچ آی وی نوع خاصی از ويروسی به نام "رتروويروس" (retrovirus) است. هرچند اين رتروويرسها نسبت به ويروس های معمولی ارگانيسم ساده تری دارند، اما از ميان بردن آنها دشوارتر است.
ژن های رتروويروسها در داخل دی ان ای سلول ها لانه می کنند. به اين ترتيب هر سلول جديدی که از سلول ميزبان تکثير شود حاوی ژن های اين ويروس خواهد بود.
رتروويروس ها همچنين ژن های خود را با ضريب خطای بالا در سلول ميزبان کپی می کنند. توام شدن اين خصيصه با سرعت بالای تکثير اچ آی وی ، باعث می شود اين ويروس با همان سرعتی که منتشر می شود، تعيير شکل نيز بدهد.
علاوه بر اين، "پوششی" که ذرات ويروس اچ آی وی در آن محفوظ است، جنسی مشابه سلول های بدن دارد که باعث می شود سيستم دفاعی بدن نتواند ذرات ويروس را از سلول های سالم به راحتی تشخيص دهد.
شرح تصوير
اچ آی وی چگونه تکثير می شود:

1- ويروس خود را می چسباند: خوشه های پروتئينی در سطح بيرونی ذرات ويروس، به دريافت کننده های پروتئينی "سی دی 4 +" سلول مقصد "ملحق" می شوند.
2- ژن ها کپی می شوند: ويروس اچ آی وی نمونه ای از اطلاعات ژنتيکی خود را کپی می کند.
3- تکثير: ويروس اين کپی از ژن ها را وارد دی ان ای سلول ميزبان می کند. وقتی سلول ميزبان شروع به تکثير می کند، بخشهای تشکيل دهنده ويروس اچ آی وی را هم تکثير می کند.
4- ويروس جديد آزاد می شود: بخشهای تشکيل دهنده ويروس اچ آی وی در نزديکی جداره سلول جاسازی می شوند. آنها يک "جوانه" را تشکيل می دهند که از سلول جدا می شود و به يک ذره جديد اچ آی وی تبديل می شود.
آلودگی
ويروس اچ آی وی در خون، مايعات تناسلی افراد و همينطور شير مادر آلوده يافت می شود. اين ويروس همراه با اين مايعات وارد بدن ديگران می شود.
راه های سرايت اچ آی وی:

- آميزش جنسی با فرد آلوده بدون رعايت اقدامات پيشگيرانه
- استفاده اشتراکی از سرنگ آلوده يا ابزاری که برای سوراخ کردن اعضای بدن استفاده می شود و آلوده هستند
- از طريق خون آلوده
- در معرض تماس قرار دادن زخم يا بريدگی در بدن با مايعات آلوده به اچ آی وی
- نوزادان مادران آلوده ممکن است در دوران جنينی، هنگام تولد يا از طريق تغذيه از شير مادرآلوده شوند
ويروس اچ آی وی در بزاق دهان شخص آلوده وجود دارد، اما ميزان آن کم تر از حدی است که بتواند بيماری را منتقل کند. زمانی که مايعات حامل ويروس خشک شده باشد، خطر انتقال ويروس نزديک به صفر خواهد بود. برای پيشگيری از انتقال اچ آی وی، بهترين راه خودداری از برقراری رابطه جنسی با فرد آلوده به ايدز و استفاده از کاندوم های جنس "لاتکس" (نوعی پلاستيک) است.
ذرات با ابعاد اچ آی وی نمی توانند از کاندوم لاتکس عبور کنند و اگر به درستی و به طور منظم استفاده شوند شيوه کاملا موثری در کاهش خطر انتقال بيماری محسوب می شوند. هرچند تنها شيوه صد در صد موثر خودداری کامل از آميزش جنسی است.
معتادان تزريقی می توانند با خودداری از مصرف سرنگ های مشترک خطر آلودگی به اچ آی وی را کاهش دهند.
- از طريق هوا، سرفه و عطسه
- از طريق بوسيدن، تماس پوستی يا دست دادن
- از طريق استفاده مشترک از لوازم آشپزی مانند ديگ و چاقو
- از طريق تماس با صندلی توالت
- از طريق حشرات، نيش يا گاز حيوانات
- از طريق شنا در استخرهای عمومی
- از طريق خوردن غذايی که توسط فرد آلوده به اچ آی وی تهيه شده باشد
مراحل ابتدايی
حدود نيمی از افرادی که تازه به اچ آی وی آلوده می شوند در عرض دو تا چهار هفته به علائمی شبيه آنفولانزا مبتلا می شوند. اين علائم شامل تب، خستگی، ناراحتی پوستی، درد مفصل، سردرد و تورم در غدد لنفاوی است.

نمودار سمت چپ فرآيند تدريجی آلودگی به اچ آی وی را نشان می دهد. واحد شمارش گلبولهای سفيد سی دی 4 + برابر با تعداد آنها در يک ميليمتر مکعب خون است. با پيشرفت ويروس از تعداد آن کاسته می شود.
يک سيستم دفاعی سالم دارای 600 تا 1200 سلول سی دی 4 + در ميليمتر مکعب است. اگر اين رقم به 200 عدد کاهش يابد، بيمار مبتلا به ايدز محسوب می شود.
"بار ويروسی" شمار ذرات ويروسی در ميليمتر مکعب است. در مراحل ابتدايی، اين رقم با تکثير سريع ويروس در خون به اوج می رسد.
در برخی از افراد آلوده به اچ آی وی سالها طول می کشد تا بيماری ايدز ظاهر شود و در اين مدت آنها احساس سلامت کرده و هيچ علائم بيرونی حضور اين ويروس در آنها ديده نشود.
در ساير افراد آلوده به اچ آی وی ممکن است علائمی مانند کاهش وزن، تب و عرق، کهير و برای مدتی کوتاه پاک شدن حافظه نمود کند.
آزمايش های اچ ای وی:
- در جريان عمومی ترين آزمايش برای تشخيص اچ آی وی، يک نوع خاص از پادتن ها يا همان پروتئين های ضدبيماری رديابی می شود
- با اين که پادتن ها در واکنش به حضور اچ آی وی در بدن توليد می شوند، اما اين اتفاق شش تا دوازده هفته پس از آلودگی رخ می دهد
- در حالی که اين پادتن ها در مبارزه با ويروس چندان موثر نيستند، اما به عنوان نشانه وجود ويروس در بدن قابل اعتماد هستند
- در چند هفته ای که رديابی آلودگی بی ثمر و جواب آزمايش منفی است، فرد آلوده می تواند ويروس را به سايرين منتقل کند.
پيشروی بيماری ايدز در بدن

سيستم دفاعی بدن که از حمله ويروس صدمه ديده است، قوای خود را برای مبارزه با بيماری ها از دست می دهد و هر نوع عفونتی می تواند جان بيمار را تهديد کند.
کسانی که به اچ آی وی آلوده هستند در مقابل بيماری هايی مانند سل، مالاريا و ذات الريه آسيب پذيرتر می شوند و با افت شمار گلبولهای سفيد سی دی 4 +، آسيب پذيری آنها از قبل هم بيشتر می شود.
بيماران مبتلا به اچ آی وی همچنين در مقابل آنچه به "عفونت های فرصت طلب" معروف است آسيب پذير هستند. اين نوع از عفونتها از باکتری های شايع، قارچ ها و انگل هايی نشات می گيرد که يک بدن سالم قادر به مبارزه با آنهاست، اما می تواند در افرادی که سيستم دفاعی بدن آنها آسيب ديده ايجاد بيماری کند و گاه آنها را از پا در آورد.
برخی از اين عوامل بيماری زا زمانی که شمار سلول های سی دی 4 + زياد است به بدل حمله می کنند، اما اکثر آنها زمانی که شمار اين سلولها به کمتر از 200 رسيد، يعنی نقطه آغاز ظهور ايدز، فعال می شوند.
در صورتی که مراقبتهای کامل پزشکی در دسترس باشد، آن وقت می توان به بيمار داروهای درمانگر و محافظ در برابر برخی از اين عفونت ها را داد. البته اين داروها گاه گران است و به علاوه می تواند عوارض جانبی داشته باشد.
*برفک
برفک و زونا
برفک يک عفونت قارچی است که معمولا به دهان، گلو يا دهانه رحم حمله می کند.
ويروس زونا،"هرپيس سيمپلکس" (herpes simplex)، می تواند در دهان يا رحم ايجاد شود. هر دو عفونت شايع هستند، اما درصد وقوع آنها در ميان افراد مبتلا به اچ آی وی افزايش می يابد و حتی می تواند افرادی را که شمار سلول های سی دی 4 + آنها هنوز بالاست مبتلا کند.
علائم: برفک باعث پيدايش برآمدگی های سفيدرنگ در پوست و خشکی دهان می شود و فرآيند بلعيدن غذا را دشوار می سازد. زونا باعث پيدايش تاول های دردناک در ناحيه مبتلا می شود.
سل*
سل عامل اصلی مرگ و مير در ميان مبتلايان به ايدز در سراسر جهان است و بسياری از کشورها همزمان با اپيدمی های اچ آی وی و سل روبرو هستند. سل ناشی از يک نوع باکتری است که بسياری از مردم حامل آن هستند، اما تنها در برخی از افراد باعث بيماری می شود.
اگر افرادی که حامل اين باکتری هستند به اچ آی وی هم آلوده شوند، احتمال بروز سل در آنها 30 برابر افزايش می يابد. سل ابتدا به ريه حمله می کند، اما می تواند به غدد لنفاوی و مغز هم سرايت کند.
علائم: سرفه شديد، درد در قفسه سينه، سرفه همراه با خون، خستگی مفرط، کاهش وزن، تب و تعرق شديد در هنگام خواب.
سرطان سيستم دفاعی بدن*
افراد آلوده به اچ آی وی بيش از ديگران در معرض ابتلا به انواع سرطانهای سيستم دفاعی بدن موسوم به ان اچ ال (Non-Hodgkin’s Lymphomas) قرار دارند. ان اچ ال می تواند به هر بخشی از بدن از جمله نخاع و مغز حمله کند و می تواند ظرف يک سال بيمار را از پا درآورد. اين بيماری می تواند، صرف نظر از شمار گلبولهای سفيد سی دی 4 + در بدن بيمار اچ آی وی، بروز کند. شيمی درمانی راه مقابله با اين نوع سرطانهاست.
علائم (ان اچ ال): تورم غدد لنفاوی، تعرق به هنگام خواب و کاهش وزن.
شمار سی دی 4+ : زير 250
زخم های بدخيم (کی اس)
کی اس (Kaposi’s sarcoma) يک نوع بيماری مشابه سرطان بوده و در ميان مردان آلوده به اچ آی وی شايع است. اين بيماری موجب ظهور زخم های (ليژن) قرمز يا بنفش رنگی می شود که معمولا روی پوست ظاهر می شود. اين بيماری همچنين می تواند دهان، غدد لنفاوی، دستگاه گوارش و ريه ها را تحت تاثير قرار دهد و مرگبار باشد. اين بيماری معمولا به بيمارانی که شمار سی دی 4 + آنها کمتر از 250 است حمله می کند، اما در کسانی که شمار اين سلول در آنها کمتر است وخيم تر خواهد بود.
علائم: زخم، نفس تنگی در صورتی که به ريه حمله کرده باشد، و خونريزی در صورتی که به دستگاه گوارشی حمله کرده باشد.
شمار سی دی 4+ : زير 200
ذات الريه (پی سی پی)
موضع: ريه
پی سی پی (Pneumocystis pneumonia) يکی از عفونت های "فرصت طلب" است که باعث ذات الريه می شود. اين عفونت معمولا به ريه حمله می کند اما همچنين می تواند غدد لنفاوی، طحال، کبد يا مغز استخوان را هدف قرار دهد. اين بيماری همواره از علل عمده مرگ و مير در ميان بيماران آلوده به اچ آی وی بوده است، اما اکنون به کمک دارو قابل پيشگيری و معالجه است. اين بيماری اغلب افرادی را که شمار سی دی 4 + در آنها کمتر از 200 است مبتلا می کند.
علائم: تب، سرفه خشک، حس فشردگی در قفسه سينه و دشواری در عمل تنفس.
شمار سی دی 4+ : زير 100
عفونت های مغزی
بيماران اچ آی وی همچنين در مقابل دو نوع عفونت، که عموما به مغز حمله می کند، آسيب پذير هستند. توکسوپلاسموسيس (Toxoplasmosis) که از يک انگل در حيوانات ناشی می شود، می تواند باعث پيدايش زخم در مغز شود. کريپتوکوکوس (Cryptococcus) - نوعی قارچ در خاک - اغلب باعث مننژيت می شود. اين بيماری در پرده نخاع و مغز عفونت ايجاد می کند و می تواند به اغما و مرگ منجر شود. اين عفونت ها در بيمارانی که شمار سلول های سی دی 4 + در آنها کمتر از 100 است شايع است.
علائم: سردرد، تب، مشکلات بينايی، تهوع و استفراغ، ضعف در يک طرف بدن، دشوار شدن تکلم و راه رفتن (توکسوپلاسموسيس)، گرفتگی عضلات گردن (مننژيت).
شمار سی دی 4+ : زير 75
عفونت شکم (ام ای سی)
ام ای سی يا ام ای آی (Mycobacterium avium complex) عفونتی است که از باکتری های موجود در آب، گرد و غبار، خاک و مدفوع پرندگان ناشی می شود. اين بيماری به لايه بيرونی معده و روده حمله می کند و در نهايت می تواند در خون و ساير بخش های بدن منتشر شود. ام ای سی اغلب کسانی را که شمار گلبولهای سفيد سی دی 4 + در آنها کمتر از 75 است مبتلا می کند.
علائم: شکم درد ، تهوع و استفراغ که به تب می انجامد، تعرق در خواب، بی اشتهايی، کاهش وزن، خستگی، اسهال.
شمار سی دی 4+ : زير 50
خطر نابينايی (سی ام وی)
سی ام وی (Cytomegalovirus) يک عفونت مرتبط با ويروس زونا (هرپيس) است و در بيماران اچ آی وی اغلب باعث ابتلا به تورم شبکيه چشم (retinitis) می شود. اين بيماری با مرگ سلول های شبکيه در ناحيه عقب چشم همراه است و در صورتی که معالجه نشود به سرعت می تواند باعث نابينايی شود. سی ام وی توسط دارو قابل مهار است. اين ويروس همچنين می تواند بر ساير بخش های بدن اثر بگذارد. اين بيماری به ندرت به افرادی که شمار سلول های سی دی 4 + آنها بيش از 100 است حمله می کند، و اغلب افرادی را که شمار اين سلول در آنها کمتر از 50 است مبتلا می کند.
علائم: مشکل بينايی مانند ديدن لکه های سياه متحرک، تاری در ديد و پيدايش نقاط کور.
داروهای ضد ايدز
از زمان آغاز اپيدمی اچ آی وی، مجموعه ای از داروها ساخته شده اند که از طريق مهار توانايی تکثير اين ويروس، عمر افراد مبتلا به اچ آی وی را به طور قابل ملاحظه ای افزايش می دهد. اين داروها از سرعت نابودی سی دی 4 + بيماران می کاهد و می تواند بروز ايدز را به تاخير بياندازد، اما آن را معالجه نمی کند.
در مجموع چهار دسته دارو وجود دارد که در مقاطع مختلف آلودگی و رشد اچ آی وی و ايدز عمل می کنند:

1) بازدارنده های ورودی: اين داروها به پروتئين های موجود بر سطح بيرونی ويروس اچ آی وی می چسبد و از پيوستن و ورود آن به سلول های سی دی 4 + جلوگيری می کند. تاکنون تنها يک نمونه از دارو، به نام "فوزيون" (Fuzeon)، وارد بازار شده است.
2) بازدارنده های ان آر تی (Nucleoside reverse transcriptase): اين بازدارنده ها ويروس اچ آی وی را از نسخه سازی از ژنهای خود باز می دارد. نوکليوسايدها مصالح ساختمانی اين ژنها هستند. اين دارو فرآيند نسخه سازی را از طريق توليد نمونه های معيوبی از اين مصالح ساختمانی مختل می کند.
3) بازدارنده های ان ان آر تی (Non-nucleoside reverse transcriptase): اين بازدارنده ها نيز فرآيند نسخه سازی را مختل می کنند. آنها با چسباندن خود به آنزيمی که اين فرآيند را کنترل می کند نسخه سازی را مختل می کنند.
4) بازدارنده های نوع پروتيز (Protease): اين داروها به آنزيم ديگری به نام پروتيز که نقشی اساسی در جمع آوری ذرات ويروس تازه دارد، می چسبند.
داروهای ضدويروس ايدز بايد به صورت ترکيبی مصرف شوند. معمولا سه نوع داروی مختلف از دست کم دو دسته مختلف از داروها به طور همزمان به بيمار تجويز می شود. با تغيير شکل دادن ويروس اچ آی وی، برخی از نمونه های اين ويروس در مقابل داروها مقاوم می شوند. بنابراين شانس کنترل اچ آی وی در صورت استفاده از چند دارو بيشتر خواهد بود. در برخی موارد از آلودگی های تازه، ويروسهايی رديابی شده اند که حتی پيش از آغاز معالجات در برابر داروهای موجود مقاومت نشان می دهند.
عوارض جانبی
عوارض جانبی شايع:
- تهوع، استفراغ، سردرد، خستگی مفرط، کهير، اسهال، بی خوابی، بی حسی در اطراف دهان، درد معده
ساير عوارض جانبی
- التهاب لوزالمعده، آسيب به کبد و لوزالعمده، زخمهای درون دهان، تغيير شکل بدن، آسيب به سلولهای عصبی، کم خونی، درد عضلانی و ضعف.
ویروس ایدز (HIV) ویروسی است که باعث نقص ایمنی بدن میشود و تولید بیماری میکند. ویروس ایدز (HIV) مخفف (Human Immuno deficincy Virus) است. این ویروس در گروه رترو ویروسها قرار دارد.
اطلاعات تکبیلی دیگر راجع به ویروس ایدز:
ویروس ایدز (HIV) ویروسی است که باعث نقص ایمنی بدن میشود و تولید بیماری میکند. ویروس ایدز (HIV) مخفف (Human Immuno deficincy Virus) است. این ویروس در گروه رترو ویروسها قرار دارد.
رترو ویروسها ، حاوی ژنوم RNA همراه با RNA پلیمراز وابسته به DNA (ترانس کریپتاز معکوس) میباشند. ژنوم رترو ویروس از دو زیر واحد مشابه ، هر یک حاوی RNA تک رشتهای مثبت ، به اندازه 7 تا 11 هزار کیلو باز تشکیل شده است. ذرات ویروسی حاوی ترانس کریپتاز معکوس هستند که برای همانند سازی ویروس ضروری است. ذرات ویروس حاوی ریبو نوکلئو پروتئین مارپیچی بوده و درون یک کپسید 20وجهی قرار دارند.
سه گروه مورفولوژیک از ذرات رترو ویروس شناخته شدهاند. ویروسهای نوع سوم بزرگترین رترو ویروسها هستند که بعضی ویروسها جزء این گروه میباشند. یکی از زیر خانوادههای رترو ویروسها ، لنتی ویرینه است که شامل عواملی هستند که قادرند عفونتهای مزمن با تخریب آهسته و پیشرونده عصبی ایجاد کنند. ویروس نقص ایمنی انسان در این گروه قرار دارد.
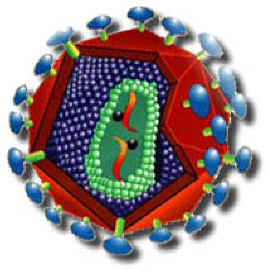
خصوصیات مهم لنتی ویروسها
-
این ویروسها دارای پوشش هستند.
-
گلیکو پروتئینهای پوشش از لحاظ آنتی ژنی تغییر میکنند.
-
برای همانندسازی آنزیم ترانس کریپتاز معکوس ، نسخهای از ژنوم DNA را از روی RNA ژنومی تهیه میکند. DNA پرو ویروس به عنوان الگویی برای RNA ویروسی عمل میکند، تغییرات ژنتیکی شایع است.
-
اعضای آن سرطانزا نیستند و سلولهای دستگاه ایمنی را آلوده میکنند. پرو ویروسها به صورت مادامالعمر در سلول باقی میمانند. بیان ویروس در بعضی سلولهای بدن محدود میباشد، بیماری مزمن آهسته و پیشروندهای ایجاد میکنند. همانند سازی به میزان زیادی اختصاصی است. گروه شامل عامل ایجاد کننده AIDS است.
ساختمان و ترکیب ویروس HIV
این موفقیت مرهون ویرولوژی مولکولی پیشرفته است که تنها 4 سال پس از شناخته شدن یک بیماری و سندرم غیر معمول به نام ADIS ، در سال 1981 ، عامل ایجاد کننده آن شناسایی و جداسازی شده است. HIV یک رترویروس و عضو زیرخانواده لنتی ویرینه است و بسیاری از خصوصیات نمادین فیزیکی _ شیمیایی خانواده خود را داراست.
خصوصیت مورفولوژیک منحصر به فرد HIV ، وجود نوکلوئیدی استوانهای در ویریون بالغ است. این نوکلوئید میلهای شکل که دارای ارزش تشخیصی میباشد، در تصاویر میکروسکوپ الکترونی دیده میشود. این ویروس سه ژن لازم برای همانند سازی را دارا میباشد. حدود 6 ژن اضافی دیگر ، بیان ویروس را تنظیم میکنند و در پاتوژنز بیماری در بدن حائز اهمیت هستند. نمونههای جدا شده مختلف HIV مشابه نیستند، اما ظاهرا طیفی از ویروسهای مرتبط به هم را تشکیل میدهند. گروههای مختلفی از ژنوم ویروسی در افراد آلوده یافت شده است.
طبقه بندی
لنتی ویروسها از گونههای بسیاری از جمله 20 گونه مختلف از پریماتها (نخستیها مانند میمونها) جدا شدهاند. دو نوع متمایز از ویروسهای انسانی ADIS به نام HIV-1 و HIV-2 وجود دارند. افتراق این دو نوع ویروس از طریق ساختار ژنومی و ارتباط فیلوژنیک با سایر لنتی ویروسهای پریمات ، صورت میگیرد. 
منشا ADIS
اعتقاد بر این است که HIV انسانی از عفونتهای بین گونهای توسط ویروسهای میمون در مناطق روستایی آفریقا ، نشات گرفته است. احتمالا انتقال توسط تماس مستقیم انسان با خون پریماتهای آلوده صورت گرفته است و بوجود آمدن تغییرات خاص اجتماعی ، اقتصادی در ابتدا و اواسط قرن 20 زمینه را برای گسترش عفونت ویروسی ، تثبیت عفونت آن در انسان و ایجاد اپیدمی فراگیر ، فراهم ساخته است.
ضد عفونی کردن و غیر فعال سازی ویروس
HIV در دمای اتاق در عرض 10 دقیقه توسط هر یک از مواد زیر کاملا غیر فعال میشود:
-
محلول سفید کننده خانگی کلردار 10 درصد
-
اتانول 50 درصد
-
ایزوپروپانول 35 درصد
-
پراکسید هیدروژن 0.3 درصد
همچنین ویروس در دو انتهای طیف PH غیر فعال میشود، اما هنگامی که HIV در خون لخته شده یا نشده ، در سرنگ یا سوزن وجود داشته باشد، باید حداقل 30 ثانیه در معرض محلول سفید کننده کلر غیر رقیق قرار گیرد، تا غیر فعال شود. ویروس توسط tween-20 ، دو و نیم درصد غیر فعال نمیشود. گر چه پارافورمالدئید ویروس آزاد در محلول را غیرفعال میکند، مشخص نیست که آیا به اندازه کافی در بافت نفوذ میکند تا تمام ویروسهای موجود در سلولهای کشت داده شده و یا نمونههای بافتی را غیرفعال سازد یا خیر؟
سیستمهای لنتی ویروس حیوانی
الگوی بیماری طبیعی در گونههای مختلف متفاوت است، اما تعدادی خصوصیات مشترک شناخته شدهاند:
-
ویروسها از طریق تبادل مایعات بدن انتقال مییابند.
-
ویروس بطور نامشخص در میزبان آلوده باقی میماند. هر چند ممکن است در سطوح بسیار کم حضور داشته باشد.
-
میزان جهشها بالا است و انتخاب جهشهای مختلف ، بستگی به شرایط متفاوتی دارد که ویروس در آن به سر میبرد (فاکتورهای میزبان ، پاسخ ایمنی و نوع بافتها). میزبانهای آلوده محتوی گروههایی از ژنوم ویروسی موسوم به شبه گونه میباشند که رابطه بسیار نزدیکی با یکدیگر دارند.
-
روند عفونت ویروسی به آهستگی طی مراحل مخصوص پیشرفت میکند. رده سلولی ماکروفاژها نقشی محوری در عفونت ایفا میکنند. لنتی ویروسها از این نظر که میتوانند سلولهای انتهایی تمایز یافتهای را که قابلیت تقسیم ندارند، آلوده کنند با سایر رترو ویروسها متفاوت هستند.
-
ممکن است تا ایجاد بیماری سالها طول بکشد. میزبانان آلوده معمولا بر ضد ویروس آنتی بادی تولید میکنند، اما قادر به پاک سازی عفونت نمیباشند. در نتیجه ویروس برای تمام عمر با میزبان باقی میماند.
-
علائم بالینی میتواند از 3 ماه تا چندین سال پس از عفونت ، در هر زمانی ایجاد شود. بطور استثنا در برخی بیماریهای لنتی ویروس دوره کمون طولانی نمیباشد. از جمله ADIS در کودکان ، آنمی عفونی در اسبها.
فاکتورهای میزبانی موثر در پاتوژنز
-
سن: افراد جوان در خطر بیشتری هستند.
-
استرس: استرس ممکن است سبب آغاز بیماری شود.
-
ژنتیک: بعضی از گونههای حیوانات مستعدتر هستند.
-
عفونتهای همزمان: ممکن است سبب تشدید بیماری یا تسهیل انتقال ویروس شود.
گیرندههای ویروسی
تمامی لنتی ویروسهای پریمات از مولکول 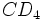 به عنوان گیرنده استفاده میکنند. این مولکول در سطح ماکروفاژها و لنفوسیتهای T وجود دارد. برای ورود HIV به داخل سلول علاوه بر
به عنوان گیرنده استفاده میکنند. این مولکول در سطح ماکروفاژها و لنفوسیتهای T وجود دارد. برای ورود HIV به داخل سلول علاوه بر 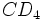 به گیرنده دیگری نیاز است. گیرنده دوم برای ادغام ویروس با غشای سلول لازم میباشد. گیرندههای کموکین به عنوان گیرنده دوم HIV عمل میکنند.
به گیرنده دیگری نیاز است. گیرنده دوم برای ادغام ویروس با غشای سلول لازم میباشد. گیرندههای کموکین به عنوان گیرنده دوم HIV عمل میکنند.
کموکینها
فاکتورهایی محلول هستند که خاصیت سیتوکینی و جذب شیمیایی دارند.
گسترش جهانی ADIS
بر اساس آمار سال 2000 ، بیشترین میزان عفونت در نواحی زیر صحرای آفریقا بوده است. در برخی شهرهای آفریقا که شیوع عفونت بالاست حدود بک سوم از بالغین به ویروس آلوده هستند. عفونت به سرعت در حال گسترش به جنوب شرقی آسیا است. به این دلیل که ایدز غالبا بالغین جوان و نیروی کار جامعه را مبتلا میسازد، اپیدمی ایدز اثرات زیانباری بر ساختار اجتماعی و اقتصادی کشورها بر جای گذاشته است.
تصور بر این است که انتشار سریع و جهانی ایدز در اواخر قرن 20 از مهاجرت عظیم جوامع روستایی به مراکز شهری همراه با نقل و انتقال افراد آلوده در نواحی مختلف جهان به دلیل معضلات شهری ، گردشگری و مسافرتهای شغلی ، نشات گرفته است.
